喜树碱类抗肿瘤药物的递送系统研究
- 健康养生
- 2023-06-14
- 127
喜树碱类抗肿瘤药物的递送系统研究
来源
《 中国新药杂志》2023年第32卷第3期
作者
赵婷婷,蔡泽东,杜琳琳,宦梦蕾,张邦乐
西北大学生命科学学院
空军军医大学药剂学与药事管理学教研室
摘要
喜树碱是一种由珙桐科植物喜树中分离得到的喹啉类生物碱,是一种天然的拓扑异构酶I抑制剂,通过与拓扑异构酶I⁃DNA形成复合物,进而阻止DNA复制及RNA合成产生抗肿瘤作用。临床研究显示,喜树碱及其衍生物具有良好的抗肿瘤活性,但因具有较高的毒副作用和较低的生物利用度而限制了其临床应用。新型药物递送系统可以弥补药物本身的缺陷,通过增强药物在体内的稳定性,提高药物的生物利用度和靶向性来达到增效减毒的目的,一定程度上解决了喜树碱类药物存在的问题。本文通过查阅近年来喜树碱类药物递送系统的国内外相关研究文献,对喜树碱类抗肿瘤药物递送系统的研究进展进行分析和总结,以期为研发满足临床实际应用的喜树碱类抗肿瘤药物提供理论指导,为该药物的新制剂研究提供一定的参考与借鉴。
关键词
喜树碱;抗肿瘤药物;药物递送系统;纳米载体
正文
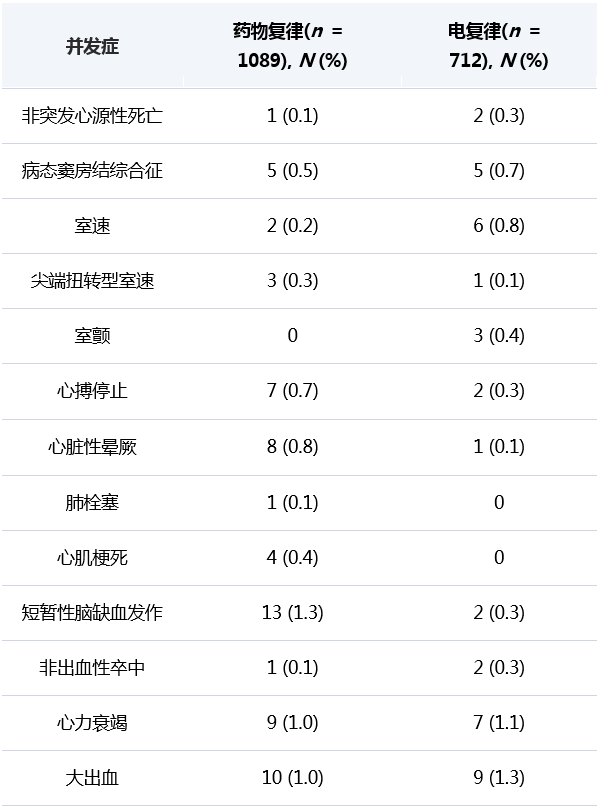
喜树碱(camptothecin,CPT)是1966年从珙桐科植物喜树中分离得到的一种吲哚类生物碱。临床研究显示,喜树碱对胃癌、肝癌、膀胱癌、结肠癌、卵巢癌、白血病和绒毛膜上皮癌等多种肿瘤均有一定的疗效,其作用靶点为DNA拓扑异构酶I(topoisomerase I,Topo I),可通过抑制DNA的复制进而诱导肿瘤细胞的凋亡[1]。作为源于中药而运用于肿瘤治疗的药物,喜树碱得到了药学家和化学家们的广泛关注。通过对其作用机制和构效关系的深入研究,研究人员已开发出一系列有效的喜树碱类抗肿瘤药物,如羟基喜树碱、拓扑替康、伊立替康、鲁比替康和9⁃氨基喜树碱等[2]。近年来的构效关系研究表明,喜树碱结构中的内酯环为药物抗肿瘤活性的必需基团,但其在生理条件下会迅速水解为非活性开环形式,这也是限制喜树碱在肿瘤临床治疗中有效应用的重要因素。另一方面,喜树碱的水溶性差且见光易分解,也使得其临床应用受到一定的限制[3]。目前喜树碱及其衍生物的剂型主要以注射剂形式用于临床治疗[2-4]。羟基喜树碱注射剂于1996年在国内上市,具有抗瘤谱广且无交叉耐药性等优势。拓扑替康是一种水溶性半合成喜树碱衍生物,其注射剂于1996年在美国上市。伊立替康脂质体注射剂于2022年4月12日在国内上市,主要用于治疗转移性胰腺癌。鲁比替康Ⅱ期临床试验研究结果表明,口服后对绝大多数实体瘤和血液肿瘤有效。9⁃氨基喜树碱注射剂的Ⅲ期临床试验表明,其对难治性复发淋巴瘤、难治性乳腺癌和非小细胞肺癌具有一定的疗效。这几类喜树碱类抗肿瘤药物的具体分子结构、剂型及作用特点见表1。作为一种有效的广谱抗癌药物,喜树碱类药物及其现有剂型具有很强的抗癌活性,但也同时存在对细胞选择性差、易产生骨髓抑制、胃肠道毒性和出血性膀胱炎等毒副作用[4]。
药物递送系统在增加药物的溶解度与控释特性、提高稳定性和增强肿瘤靶向性等方面发挥着重要作用,对抗肿瘤药物的增效减毒和生物利用度的改善具有重要意义[5]。与传统制剂相比,药物递送系统可大大提高难溶性药物的生物利用度,提高药物在肿瘤部位的富集并减小药物的毒副作用。本文通过查阅喜树碱类抗肿瘤药物相关递送系统研究的国内外文献,从现有制剂新技术与新剂型研究角度,对已报道的脂质体、聚合物胶束、纳米粒、微球、高分子前体药物等不同类型的喜树碱类药物递送系统的研究进行分析、总结和归纳,并对其临床应用面临的挑战进行分析,以期为喜树碱类药物新制剂研发和开展相关研究工作提供一定的参考与借鉴。
1
脂质体
脂质体是一类由胆固醇和磷脂分子构成的双分子层封闭囊泡,可包封药物形成微型泡囊药物递送体系。脂质体具有极好的生物相容性和生物降解性,是一种安全有效的药物载体,可以使被包封药物在体内的稳定性增强,携载药物被动或主动靶向到病变部位[6]。此外,脂质体还具有可规模化生产、增加细胞摄取率、降低用药剂量以提高患者依从性等优点[7]。
喜树碱类药物的一个重要问题是在生理条件下不稳定[8],内酯环是抗肿瘤活性的必需结构,但其具有pH依赖性,因此提高此类药物疗效的关键是保护药物的内酯结构,避免其水解失活。将喜树碱包封于脂质体中能够增加其内酯环稳定性,从而能够保持其活性内酯结构不发生转变[9]。然而传统脂质体容易被网状内皮系统清除,也缺乏有效的靶向能力。用聚乙二醇(polyethylene glycol,PEG)修饰脂质体可提高脂质体制剂的体内稳定性和循环时间。伊立替康(CPT⁃11)是在喜树碱A环10位引入氨基甲酸酯基、B环7位引入乙基后的衍生物。Yoshino等[10]制备了PEG修饰的CPT⁃11脂质体。与普通CPT⁃11脂质体相比,PEG修饰后的脂质体提高了在血液的循环时间,大大增强了其疗效。为了进一步提高肿瘤靶向性,研究者还制备了肿瘤主动靶向脂质体和温敏脂质体。前者通常偶联特异性配体与肿瘤细胞表面受体结合,使药物靶向性得到提高。而温敏脂质体可以受温度控制达到合理释放药物。Casadó等[11]制备了CPT⁃11温度敏感脂质体,可在肿瘤部位快速释放CPT⁃11,增大了药物在肿瘤细胞的浓度,从而增加了药物的生物利用度和疗效。
He等[12]开发了一种用于治疗肿瘤的氧化还原响应型的喜树碱脂质体系统。通过二硫键将喜树碱与甘油磷酸胆碱偶联,合成CPT⁃SS⁃GPCs并组装成脂质体(见图1)。这种脂质体在肿瘤细胞内还原性环境中可有效释放。体外和体内分析评价结果显示,CPT⁃SS⁃GPCs脂质体显著提高了喜树碱的载药量,体内稳定性高且在肿瘤细胞内可以快速释放,在肿瘤治疗中具有一定的应用潜力,但具有难以克服脂质体磷脂氧化、可控释药与稳定性差的问题。
文章内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果, 注明【来源:凡默谷公众号】。
2
聚合物胶束
聚合物胶束是由两亲性共聚物通过自组装形成的热力学稳定的胶体。与脂质体双分子层结构不同,胶束为单分子层结构,其载体多为人工合成,在水性介质中热力学稳定,具有更小的粒径分布。可将疏水性药物包裹进疏水内核以提高药物溶解度和对肿瘤细胞的靶向性。亲水性的外壳可以改善药物在体内的药动学特性,提高药物疗效。白霜[13]以天然葡聚糖(DEX)为骨架,采用原子转移自由基聚合(ATRP)的方法,合成了一种氧化还原响应型聚合物药物输送系统(DEX⁃PCPT⁃b⁃POEGMA,简称为DCO)并用于喜树碱的递送。该两亲性聚合物的亲水部分聚(乙二醇甲基丙烯酸酯,POEGMA)可延长药物在血液的循环时间,疏水部分为含有二硫键(S⁃S)的喜树碱单体,可实现药物的肿瘤细胞内响应型可控释放。该聚合物胶束对人宫颈癌细胞(HeLa)和人乳腺癌细胞(MCF⁃7)均有明显的抗肿瘤活性。与含有碳键(C⁃C)的无刺激响应型纳米粒相比,含有S⁃S的纳米粒极大增加了肿瘤细胞凋亡率,具有明显的优效性。
SN38为伊立替康的活性代谢产物,其结构为7⁃乙基⁃10⁃羟基喜树碱。Lu等[14]将SN⁃38包裹进由mPEG⁃PLA自组装成的胶束中,发现其抗肿瘤活性显著增强,在增强药物靶向性的同时,还延长了药物在体内的滞留时间,使其可以发挥缓释作用。Liu等[15]报道了一种可裂解的喜树碱前体药物,这种前体药物可以稳定地包埋在甲氧基聚乙二醇⁃聚乳酸(mPEG⁃PLA)胶束中(见图2),在生理条件下它可以裂解释放出药物,产生强大的细胞毒性作用,显示出优异的靶向肿瘤能力与递送疏水药物的高效潜力。
3
纳米粒
脂质材料或药物经纳米化制备技术制成的粒度在纳米数量级的固体颗粒。根据材料不同分为聚合物纳米粒、固体脂质纳米粒和药物结晶纳米粒三大类。
3.1 聚合物纳米粒
聚合物纳米粒是以天然高分子材料、合成高分子材料为载体,将药物包裹其中制成的递药系统。Wang等[16]将SN38负载于聚多巴胺纳米粒中开发了一种多功能的骨靶向递送系统PDA⁃ALN,并结合光热治疗将其用于恶性骨肿瘤的治疗(见图3)。
该纳米粒具有良好的光热效应,而且阿仑膦酸(alendronate,ALN)能显著增强与骨组织的亲和力,促进纳米粒在溶骨性病变中的积累。与非靶向纳米粒相比,PDA⁃ALN在肿瘤溶骨性骨病变处的积累显著增强,并可实现喜树碱类药物SN⁃38的高效负载。研究发现近红外照射和弱酸性pH的刺激均可触发药物释放,在43℃左右温度下,化疗⁃光热联合治疗能有效抑制骨肿瘤的生长,同时减少了骨的溶骨性损伤,为恶性骨肿瘤的治疗提供了一种高效治疗药物。
Yang等[17]开发了一种可以分别负载亲水性阿霉素(doxorubicin,DOX)和疏水性喜树碱的夹心复合纳米粒(见图4)。在pH或近红外激光照射的刺激下能够表现出完全不同的释放模式。喜树碱和DOX在肿瘤组织酸性微环境下,会以独特的两阶段方式逐步释放,2种药物之间不存在相互干扰。这种载药纳米粒可在肿瘤部位快速释放达到较高的药物浓度,提高疗效的同时也减少了对正常组织的毒副作用。与单药化疗相比,这种多药复合制剂显著提高了相关肿瘤的疗效。
3.2 固体脂质纳米粒
固体脂质纳米粒是以固态天然或合成的类脂如卵磷脂等脂质材料为载体,将药物包裹其中制成的递药系统。利用固体脂质纳米粒包裹喜树碱类药物可降低药物毒性、提高药物滞留时间、增强抗肿瘤效果。Jang等[18]通过热均质化方法制备了CPT⁃SLNs并研究其对人结肠癌细胞的抗肿瘤效果。研究结果发现,与喜树碱相比,CPT⁃SLNs能维持较好的血药浓度,对人结肠癌细胞的抑制活性大大增强。固体脂质纳米粒具有脂质体和纳米粒的双重特性,是近年来发展起来的新一代给药系统,具有毒性低、生物相容性好、生物可降解等优势,但由于为多相体系,同时存在过高载药量导致凝胶化,存放过程发生粒径增长或药物降解等载药量低、稳定性差的问题,一定程度限制了其广泛应用。
3.3 药物结晶纳米粒
药物结晶纳米粒是药物经纳米化技术制成的纳米粒度药物晶体。由于极小的粒径使其具有非常大的比表面积,可改善难溶性药物的溶解度和溶出度,提高其生物利用度,也可提高载药量、改善其体内分布等。Wang等[19]成功制备了HA包覆的喜树碱纳米晶药物,并利用HA的靶向引导将喜树碱主动靶向递送到过表达CD44受体的肿瘤细胞(见图5)。研究结果证实,HA包覆的喜树碱纳米晶具有较高的载药效率,可延长体内循环时间,增强了喜树碱的稳定性。与喜树碱游离药物和裸喜树碱纳米晶相比,HA包覆的喜树碱纳米晶具有更好的抗肿瘤活性,增强了对癌细胞的凋亡诱导作用。由于CD44特异性介导的内吞作用,HA包覆的喜树碱纳米晶也降低了对正常细胞的毒性,有望成为喜树碱类抗肿瘤药物的有效递送方式。
4
微球
微球是以天然或合成的高分子材料为载体,将药物溶解或分散在载体中形成的球状实体。微球制剂具有掩盖药物的不良气味及口味、提高药物的稳定性、制备缓释和控释制剂、使药物浓集于靶区、提高疗效、降低毒副作用等特点。喜树碱类药物的微球制剂已有很多研究报道。聚乳酸⁃羟基乙酸共聚物(polylactic⁃co⁃glycolic acid,PLGA)是一种可降解的功能高分子材料,具有生物相容性好、成型性良好、且对机体无害等特点。Ayyanaar等[20]制备了喜树碱的PLGA⁃PVA磁性微球(CPT⁃MMSs,见图6)。该微粒可通过活性氧(ROS)响应触发喜树碱的释放,是一种有效的ROS响应性靶向药物传递系统,表现出明显的ROS响应性药物释放特性,可显著提高负载药物的抗肿瘤活性。
5
高分子前体药物
前体药物指能在体内转化成活性母体药物的药理惰性物质。前体药物近年来也被广泛应用于药物递送系统设计中,可提高药物生物利用度和稳定性,使药物缓释长效释放。与药物的物理包封方法相比,高分子前体药物可以定量控制载药量,并具有更高的载药效率。近年来有许多科研工作者对喜树碱类药物进行了前体药物设计。Zhang等[21]将pH敏感的喜树碱游离药物与甲基丙烯磷酸胆碱(MPC)进行聚合,制备了含喜树碱的聚合物前体药物PCPT(见图7)。将pH敏感的前体药物通过酰胺化反应连接在聚多巴胺(PDA)纳米粒表面,结合化疗和光热治疗协同治疗肿瘤。研究证实,PDA@PCPT纳米颗粒能够被HeLa细胞有效摄取,可将喜树碱转运到肿瘤细胞中,而且其协同疗效明显优于单一的化疗和光热疗效。
徐冰[22]在前药原理指导下,将前列腺膜抗原(prostate specific membrane antigen,PSMA)与喜树碱的20⁃位羟基进行偶联,构建了肿瘤靶向喜树碱前药CPT⁃X,以期提高喜树碱的水溶性、稳定性及靶向性,降低其毒副作用。实验结果证实,设计合成的肿瘤靶向喜树碱前体药物能有效地在肿瘤部位聚集并发挥抗肿瘤作用,表现出强的细胞毒性、靶向性和稳定性。该前体药物成功克服了喜树碱水溶性、稳定性及靶向性差的缺陷,同时显著延长了其半衰期。何东旋[23]通过双羟基二硫化物将伊立替康与喜树碱连接起来,制备出还原性响应的两亲性喜树碱前体药物,其在还原环境下能够快速释放出喜树碱及伊立替康母体药物发挥疗效。
Yuan等[24]合成了一种新的酯酶敏感的肿瘤靶向聚合物喜树碱前体药物(见图8),并研究了其体外和体内的抗前列腺癌活性。与游离喜树碱相比,该高分子前体药物可稳定喜树碱的内酯结构以及延长循环时间,在体外培养的人前列腺癌细胞(DU145)中显示出更好的水溶性和稳定性、更高的细胞内摄取和更强的细胞毒性。体内实验也证实,其可大大增加药物在肿瘤部位的蓄积,从而增强其抗癌活性。
6
其他递送系统
除了常规的制剂技术外,一些基于无机材料和碳纳米管的递送体系也被用于喜树碱类抗肿瘤药物的递送研究。碳纳米管是由碳原子组成的管状疏水性网络,其直径约为1~4nm,长度为1~100μm,具有独特的电子、光学和机械性能。碳纳米管进行化学修饰后可以使其成为水溶性载体,增加其生物相容性并降低毒性。由于其具有超高比表面积,可以将药物分子负载在其表面或其内腔中形成高载药量的新型载体。Sahoo等[25]利用非共价超分子附着技术,通过p⁃p相互作用将喜树碱负载到具有高亲水性和生物相容性的聚乙烯醇(PVA)功能化的多壁碳纳米管(MWCNTs)和氧化石墨烯(GO)上,MWCNT⁃PVA和GO⁃PVA可以通过非共价相互作用与喜树碱形成稳定的配合物。四唑盐比色(MTT)法检测发现,与单独使用游离喜树碱相比,MWCNT⁃PVA⁃CPT和GO⁃PVA⁃CPT表现出更高的抗肿瘤活性,对MDA⁃MB⁃231人乳腺癌细胞的效力大约是游离喜树碱的15倍。
Ren等[26]开发了一种多响应纳米治疗系统,以氧化锰覆盖磁铁矿作为T1和T2核磁共振(MRI)造影剂,负载于介孔二氧化硅无机材料,可同时实现多响应释药和MRI增强作用。一方面,该递送系统可以实现氧化还原响应、酸响应性和氧化应激解离释放药物。另一方面,氧化锰释放的Mn离子可提供更大的T1MRI对比度。研究结果显示,MnOx⁃SPI⁃ON@MSN具有良好的生物相容性,能够响应性释放药物,对胰腺癌荷瘤小鼠具有明显的治疗作用,肿瘤组织可以完全消退。
7
结语与展望
喜树碱类药物为临床应用的有效Topo I抑制剂,被广泛用于多种肿瘤的治疗。但由于其较差的水溶性、易于开环失活和严重的毒副作用,限制了其在临床的进一步应用。纳米递药系统能够提高喜树碱类药物的水溶性,还能够防止其在生理条件下开环失活,可实现减毒增效的目的。用于喜树碱类抗肿瘤药物的不同药物递送系统具有不同的应用特点[27-28],通过构建脂质体、聚合物胶束、纳米粒、微球、高分子前体药物等不同类型的递送系统,一定程度上克服了喜树碱类药物在给药途径、体内分布、药动学等方面的问题,但就目前而言,喜树碱类药物的递送系统仍存在一些问题,如载药量低、稳定性差、释药可控性差、纳米载体特殊毒性(如产生对胃肠道的刺激,出现中性粒细胞减少等现象)以及肿瘤多药耐药等。因此,在研究新的递药系统和优化现有载体时,应注意递药系统的人体安全性与毒性评估,在保证安全的前提下提高喜树碱类药物的抗肿瘤效果。
随着纳米医学和药物制剂新技术的飞速发展,多种智能响应型递药系统得到广泛研究,结合各种内源性(如pH、氧化还原、酶活性)或外源性(如磁场、光、温度、超声波)刺激作为药物释放因素可望解决释药可控性差的问题[29]。针对肿瘤多药耐药,新发现的细胞死亡方式,如铁死亡可与喜树碱类抗肿瘤药物联合应用,能够有效避免多药耐药的发生[30],将2种不同细胞死亡方式的药物共负载可进一步提高递药系统的治疗有效性。此外,诊疗一体化平台是近年来提出的集诊断和治疗于一体的新型递送模式。设计新型诊疗一体化平台用于负载喜树碱不仅能够杀死肿瘤细胞,还能够起到实时监测肿瘤疗效的作用。新型喜树碱类抗肿瘤药物递送系统的合理设计可为其新制剂研发提供新的思路,对开发高效喜树碱类临床治疗药物具有重要的意义。
参考文献
《中国新药杂志》2023年第32卷第3期
点击图片,查看详情
免责声明
本公众号发布的文章均为促进制药界同行的交流与学习;不用于任何商业用途。 我们尊重原创作品。选取的文章已明确注明来源和作者,版权归原作者所有,如涉及侵权或其他问题,请联系我们进行删除。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果, 注明【来源:凡默谷公众号】。
文章内容为作者观点,不代表本公众号立场。
文章搜索
本公众号开通往期文章任意搜功能啦
在公众号菜单栏中输入“搜索”,即可搜索往期微信内容
封面图片来源于:/