急性淋巴细胞白血病 | CAR-T、双抗等4种创新疗法的临床结果
急性成淋巴细胞性白血病(ALL)是一种起源于B系或T系淋巴祖细胞的肿瘤性疾病,多发于儿童,是预后比较好的急性白血病。目前治疗方式也多种多样,包括化疗、骨髓移植和免疫治疗等。
近年来发展起来的靶向治疗、联合治疗和细胞治疗等方式把ALL的治疗推向了另一个高潮。美国血液学会( of ,ASH)2019年会已落下帷幕,会上许多科学家报告了在ALL领域创新疗法取得的可喜成果。本文笔者将和大家分享其中的4篇,一窥这一疾病治疗的最前沿科技。
1、INO++低强度超CVD化疗

该项目的主要研究者是来自美国德州MD 癌症中心白血病系的教授Elias 。他长期致力于白血病疗法的开发。在过去的5年里,他协助开发了白血病的化疗和生物疗法,并且对其他疗法也作出了贡献。
与常规化疗相比,-(INO)和均能提高复发或难治性ALL的生存率。INO联合小强度超CVD化疗治疗老年初诊ALL安全有效。在这个方案中加入可以进一步改善疗效。
新诊断为费城染色体(Ph)阴性的前体B细胞ALL 60岁以上患者(pts)均符合条件。要求患者的性能状态为≤3,总胆红素≤1.5mg/dl,AST/ALT≤3x ULN,肌酐≤2mg/dl。
患者接受小剂量高CVD(环磷酰胺和地塞米松50%剂量减少,无蒽环类,甲氨蝶呤75%剂量减少,阿糖胞苷0.5g/m2 x 4剂量)长达8个周期。INO在第1个周期的第3天给药1.3-1.8mg/m2,在第2-4个周期的第3天给药0.8-1.3mg/m2。
前4个周期给予(如果CD20+)和预防性IT化疗。响应患者接受为期3年的POMP维持治疗。
为了降低静脉闭塞性疾病(VOD)的风险,在2017年3月修订了该方案(患者50+),每个周期给INO分次剂量(第1周期第2天0.6 mg/m2,第8天0.3 mg/m2;第2-4周期第2天0.3 mg/m2,第8天0.3 mg/m2),并在4个周期的高CVD加INO后给药4个周期的,随后通过12个周期POMP和4个周期(每3个周期POMP后进行1个周期)。
64名患者接受了治疗,其中5名在入院时完全缓解(CR)。患者特性总结见下表。中位年龄为68岁(60-81岁);27名患者(42%)年龄≥70岁。TP53突变阳性28%,CRLF2阳性19%,不良风险核型27%。33/58例(57%)为CD20+,接受利妥昔单抗。
在59例可评价形态学反应的患者中,58个(98%)有反应(CR,n=51;CRp,n=6;CRi,n=1)。6色流式细胞术检测1个周期和所有治疗后MRD阴性率分别为48/62(77%)和59/63(94%)。无早期死亡,30天和60天死亡率分别为0%和3%。
在63例获得缓解的患者中,9例(14%)复发,3例(5%)在首次缓解时接受异基因SCT,30例(48%)仍在治疗或已完成维持,21例(33%)在CR/CRp期间死亡。CR/CRp的死亡率在≥70岁的患者组高于60-69岁的患者组(50% vs 22%;P=0.02)。
CR/CRp中患者的死亡原因包括:败血症(n=7;均为70岁及以上)、VOD(n=3)、枪伤(n=1)、痴呆和疾病解除(n=1)、终末期肾病(n=1)、MDS/AML(n=4;70岁及以上患者3例)和不明原因(n=4)。6名患者(9%)出现VOD,1名患者在随后的同种异体SCT后出现VOD。
中位随访37个月(2-85个月),34例患者(53%)存活,其中30例(47%)CR和MRD阴性。3年持续缓解率和OS率分别为76%和54%(下图A)。60-69岁和≥70岁的患者3年持续缓解率分别为69%和87%(P=0.25),3年OS率分别为63%和42%(P=0.13;下图B)。
≥70岁患者生存率下降的趋势主要是由于老年组CR/CRp死亡率的增加。接受或不接受治疗的患者的结果相似。与用超CVAD+利妥昔单抗治疗的老年组历史数据相比,低强度超CVD + INO± 3年OS显著增高(54% vs 32%,P=0.007)【1】。
总之,低强度高CVD化疗加INO的,加或不加,对初诊断Ph阴性的老年人是安全有效的,总有效率为98%,3年OS率为54%。在70岁及以上患者中,进一步优化该方案,减少化疗,有助于进一步降低缓解期的死亡率。

2、靶向CD19的快速CAR-T治疗

该项研究的主要负责人为中国陆道培医院医疗执行院长陆佩华。她同时也是美国血液病及肿瘤内科专家和中国临床肿瘤学会 (CSCO) 抗白血病联盟专家委员会常务委员。其在细胞治疗特别是CAR-T治疗方面有杰出研究。
以CD19为靶点的嵌合抗原受体(CAR)T细胞治疗已取了成功,但其治疗潜力仍有待进一步提高。此外,CAR-T生产成本高、工艺流程长,限制了其广泛应用。本研究开发了一个名为快速CAR-T的新平台,将生产时间缩短到一天(加上7天的额外监管要求测试)。
本文报告了快速CAR-T()的临床前研究和一期临床试验的结果,以评估治疗CD19+复发/难治性B-ALL的安全性和可行性。
在本研究中,利用快速CAR-T平台制造了第二代CD19定向CAR-T。外周血(PB)单核细胞是从临床前研究的健康供体或接受临床试验的患者中通过白细胞清除术获得的。
分离T细胞用于CAR-T的产生。采用异种小鼠模型测定的体内药效。从同一健康供体中提取的常规(C)CAR-T也进行了平行试验以进行比较。
2019年2月至2019年7月,10名CD19+复发/难治性B-ALL的青少年和成人患者参加了CD19 快速CAR-T的可行性试验。所有患者的快速CAR-T细胞均成功制造。所有患者均接受静脉注射氟达拉滨(30mg/m2/d)和环磷酰胺(250mg/m2/d)3天的预处理方案,然后单次输注CAR-T细胞。
6例患者接受低剂量6.5(5.86-7.04)x104/kg快速CAR-T,2例接受中剂量1(1-1.16)x105/kg,1例接受高剂量1./kg。本研究的主要终点是评估可行性和毒性,次要终点包括输注的快速CAR-T细胞的疾病反应和植入/持久性。
这项临床前研究显示靶向CD19的F-CAR-T比C-CAR-T有几个显著的改善:1)5-30倍的体外增殖能力(p
一期临床试验的中位观察期为86天(37-166天)。治疗前骨髓母细胞(BM)中位百分率为9.05%(0.19-32.5%)。在输注CAR-T细胞后第15天,10/10(100%)患者达到CR或CRi,9/10(90%)患者的MRD为阴性。
第15天,10名患者中有4名血细胞计数恢复良好。在第30天,这个数字进一步增加到6/10。F15患者的PB比例从入组时的1%增加到CAR-T细胞输注前的7%,并在输注后的第7天增加到77%,病情迅速发展。
尽管疾病进展迅速,患者在第15天达到MRD阳性CR,残留0.06%BM细胞。10例患者中有5例被转移到allo-HSCT。到目前为止,所有10名患者仍处于CR状态。用qPCR和流式细胞仪检测CAR-T输注后PB中CD19快速CAR-T细胞水平。
无论输注CAR-T剂量如何,均能检测到良好的体内增殖和持久性。在第7天(7-10天)中位峰值水平达到2.1(0.22-5.2)x105拷贝/µg基因组DNA(下图),中位CAR-T表达率为44.5(13.6-69.5)%。
第7天左右出现IL6、IFNγ、IL10和CD25峰值。尽管取得了很高的CRS率,但9/10患者有1级细胞因子释放综合征(CRS),不过只有1名患者有3级CRS。没有发现神经毒性【2】。
本研究表明,快速的CAR-T细胞具有良好的扩增能力和较少T细胞耗竭的表型。这项首次在人体内进行的临床研究表明,快速CAR-T治疗B-ALL是安全有效的。

3、 + 联合治疗

领衔该项研究的是 J. ,他是美国斯坦福大学 -儿童医院儿科(血液学和肿瘤学)副教授。
对于R/R ALL和淋巴母细胞淋巴瘤(LLy),对新的治疗策略的需求仍未得到满足。(vene)是一种高选择性的BCL-2抑制剂,对成人恶性血液病有一定疗效。(Nav)是一种具有良好疗效的BCL-2/BCL-XL/BCL-W抑制剂,但长期血小板减少限制了其在高剂量下的持续应用(J Clin Oncol. 2012;30:488)。
在之前的一份32例ALL患者的报告中,Ven+Nav耐受性良好,无意外毒性,初步疗效良好(EHA 2019. Abstr #PS940)。本文报告了36例ALL或LLy患者的最新结果,这些患者接受了Ven+Nav和化疗。
这项1期,多中心,开放标签,剂量递增研究纳入年龄≥4岁的R/R ALL或LLy患者(NCT )。患者在第1天接受体重调整后当量为200mg的静脉注射,此后每天接受400mg当量静脉注射。
从第3天起,根据贝叶斯最优间隔设计,对体重≥45kg的患者给予25、50或100mg的口服每日Nav,或对体重20至
临床上要求在第8天和第36天通过流式细胞术评估疾病发生。如果有临床症状,在疾病评估时进行MRD评估(对于无法检测到的MRD,低于10-4临界值)。
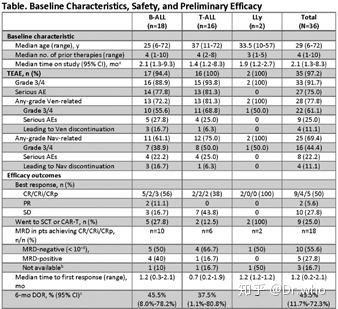
截至2019年5月6日,共有36名患者登记入组,分别为B细胞ALL(B-ALL,n=18)、T细胞ALL(T-ALL,n=16)或LLy(n=2)。中位年龄为29岁(6-72岁),其中包括7名儿童患者(见下表),患者有4名既往治疗(1-10),其中5名(14%)为既往SCT,6名(17%)为既往CAR-T治疗。
研究中位时间为2.1个月(1.3-8.3个月)。最常见的治疗引起的AEs是恶心(47%)、呕吐(42%)、腹泻(42%)、低钾(42%)、腹痛(36%)、发热性中性粒细胞减少(33%)、ALT升高(31%)和中性粒细胞减少(31%)。
1例以上3/4级与静脉相关的非血液学不良事件是呕吐【3(8%)】;只有与Nav相关的血液学事件发生在1例患者以上。剂量限制性毒性包括肠缺血(n=1,100 mg Nav,≥45 kg);药物性肝炎(n=1,50 mg Nav,≥45 kg);计数恢复延迟(n=1,25 mg,
三例有致命AEs的患者与疾病进展无关,包括2例败血症和1例已知潜在心律失常的心脏骤停。另外四名患者在接受研究药物或停止研究药物30天内死于疾病进展(缺血性肠、败血症、呼吸衰竭和其他)。
ORR为56%(20/36),其中CR/ CRi/ CRp为18%(50%;下表)。在儿童患者中,ORR为86%(6/7),其中5例患者(71%)的CR/CRi/CRp反应最佳。在18例CR/CRi/CRp患者中,10例(56%)MRD不可检测。25%的患者在获得良好的反应后继续进行SCT或CAR-T。
与之间没有明显的药物动力学相互作用。通过BH3谱初步评估线粒体启动,证实患者ALL细胞依赖于BCL-XL和/或BCL-2。基因组分析正在进行中【3】。
总之,Ven+Nav联合化疗具有良好的耐受性,在R/R ALL或LLy的患者中,AEs很少停药或减少剂量。Ven+Nav在患者中的初步疗效是有希望的,包括既往SCT或CAR-T治疗患者,具有高CR/CRi/CRp,其中10/18(56%)MRD不可检测的患者。
4、在Ph-neg ALL的二期临床

领衔该研究的PI是 Orfao,他是西班牙西尼科大学医院癌症研究中心(IBMCC-CSIC/USAL)流式细胞服务部主任。主要从事血液恶性疾病研究。
最近的研究表明,接受儿科诱导化疗方案治疗的费城染色体阴性(Ph-neg)ALL患者,如果在诱导和/或巩固治疗后MRD检测获得良好的反应,似乎都不需要异基因造血干细胞移植()。与未接受的患者相比,MRD反应不好的患者在治疗中取得更好的疗效。
然而,尚不清楚这种方法是否能特别适用于基线时具有高风险(HR)特征的ALL患者。西班牙组的前瞻性ALL-HR-11试验()的目的是根据诱导(第5周)和巩固治疗结束时(第17周)的MRD水平(由8色流式细胞术FCM评估)评估HR-Ph-neg成年ALL患者对不同诱导后治疗(化疗或)的反应。
HR均包括一个或多个基线参数:年龄30-60岁,B细胞前体ALL计数>/L,胸腺T-ALL、pro-B、早期或成熟T-ALL、11q23或KMT2A重排或复杂核型>/L。诱导治疗包括4周的长春新碱、强的松、柔红霉素和天冬酰胺酶(诱导-1,根据可获得性)。
未达到CR的患者或MRD≥0.1%的CR患者在诱导结束时给予FLAG-Ida作为强化诱导(诱导-2)。对于CR和MRD
如果合并后MRD水平
截止2019年4月,307高风险ALL患者可评估。中位(范围)年龄为40(15-60)岁,192名男性,211名前体B-ALL和96名T-ALL,中位白细胞计数为12.9(0.2-564)x109/L。诱导-1的结果(诱导时n=304):治疗相关死亡:12(4%),耐药:39(13%),CR:253(83%)。
77%的CR患者在诱导结束时MRD
根据诱导-1后的治疗意图,94名患者被分配到,190例分配到延迟巩固和维持。分配给的患者5年CIR和OS概率分别为37%±13%和38%±11%,化疗的患者5年 CIR和OS概率分别为48%±10%和55%±10%(OS的P
MRD在诱导结束时
总之,诱导后治疗仅基于FCM评估的MRD结果,提示避免并不妨碍HR-Ph-neg成年ALL患者诱导后和巩固后MRD反应充分的结果。对于MRD清除率低的患者,特别需要更好的缓解后替代疗法。
5、小结
CAR-T等细胞治疗于2017年后掀起了一波又一波的狂潮,目前在血液疾病中取得了不凡的结果。目前主要的困难是生产时间长等问题。快速CAR-T的研发有助于争分夺秒挽救危重症病人。当然,如果能够成功研发异体CAR-T,则很大程度上能够解决这个问题。不过快速CAR-T技术也说明中国在这方面的研发已走到世界前列。
也是近年来的热点。通过30年的研发,这款由和研发的这款产品终于被FDA批准用于慢性淋巴细胞白血病(CLL)。BCL-2这个靶点由于其特殊性一直难以成药,不过最终被攻破。目前国内的亚盛医院在细胞凋亡通路药物上走在前列,有许多相关药物已经开展临床试验,希望不久的将来能给患者带来更多的福音。
参考文献:
【1】 J. Short, Hagop M. , , Huang, Nitin Jain, Koji , Rita , Naval G. Daver, , D. , L. , Yesid , Y , -, Tapan M. Kadia, Musa E. , M. , Jan A. , M. , G. , D. , , Jacob, , , Ward, Binru Huang, , , Susan M. O'Brien, and Elias . 823 of a Phase II Study of - with Mini-Hyper-CVD in with , with or , in Older with Newly - Acute .
【2】 Yang, He, Xian Zhang, Wang, Zhang, Cai, Zhe Sun, Xun Ye, Yan He, Shen, MD, PhD, He, Zhang, MD, Dan Song, Min Zhang, Hu, Li1, Xia, Li Xu, Wei Cao and Lu. 825 A and Study of a New CD19- Fast CAR-T for and B Cell Acute .
【3】 J. , Vinod A. , Wendy Stock, Elias , Bajel, , , G. , Seong Lin Khaw, Susan I. Vear, T. , Ahmed Hamed Salem, , Bo Tong, Lang Zhou, A. Ross, , , Robin , . and of in with in Adult and / Acute and .
【4】Josep-Maria , , M.Prob.S, Juana , Pau , Pere Barba, Irene García-, María José , Vives, Jordi , Gil, , María , Jordi , Eulàlia à, Mar Tormo, Marta , Martínez-, Andrés Novo, José González-, Soria, Bermúdez, López Martínez, , Rosa Fernández-Martín, Rosa Coll, , Maria Luz Amigo, Pilar Martínez-Sánchez, Juan- , -, Giménez Conca, , , Feliu, Orfao. Post- with or Stem Cell () in Adult with High-Risk (HR) - (Ph-neg) Acute (ALL) to Their (MRD). Final of the ALL-HR-11 Trial.
 问答百科
问答百科